Glossaire
Acide désoxyribonucléique (ADN ou DNA chez les anglo-saxons) : Acide nucléique, constituant chimique essentiel des chromosomes du noyau des cellules vivantes.
L’ADN est composé de deux brins torsadés qui forment une double hélice et qui sont liés entre eux par des paires de bases azotées : l’adénine (A), la thymine (T), la cytosine (C), la guanine (G). L’ADN d’une seule cellule humaine mesurerait près de 2 mètres, s’il était déroulé, et contiendrait l’équivalent en information de 600 000 pages d’écriture.
Acides nucléiques : Constituants fondamentaux de la cellule vivante, porteurs de l’information génétique, polymères constitués de très nombreuses unités de nucléotides.
On les divise en 2 groupes selon le type d’ose (sucre) qui entre dans leur composition :
- l’acide désoxyribonucléique (ADN ou DNA chez les anglo-saxons)
- les acides ribonucléiques (ARN).
Adsorber : Fixer des ions libres, des atomes ou des molécules à la surface d’une substance.
Amylase : Enzyme facilitant la transformation de l’amidon insoluble en maltose.
Amylopectine : Polysaccharide de l’amidon ou de la fécule dont les macromolécules présentent une structure ramifiée.
Amylose : Polysaccharide de l’amidon ou de la fécule dont les macromolécules présentent une structure à prédominance linéaire.
Anaérobie : Qui peut vivre en l’absence d’oxygène.
Anaérobiose : Ensemble des conditions nécessaires au développement des organismes anaérobies.
Anoxique : Qui se rapporte à l’absence ou à une diminution importante de la quantité d’oxygène.
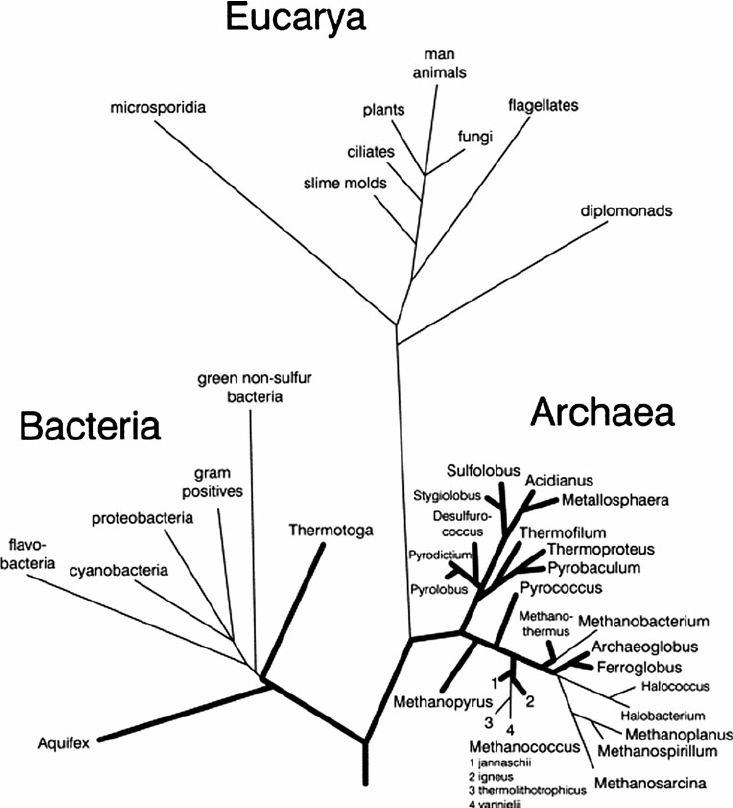
Arbre phylogénétique : Arbre qui montre les relations de parentés entre les espèces ou d’autres entités supposées avoir un ancêtre commun.
Atmosphère normale : Ancienne unité de pression atmosphérique. 1 atm correspond à 1,013.105 pascals.
Autoclavage : Action de passer un produit en autoclave. Un autoclave est un récipient fermé par un couvercle, destiné à obtenir et à maintenir, grâce à la pression qui s’y développe, la température élevée (120 °C) nécessaire pour stériliser les substances et le matériel enfermés à l’intérieur.
Bactérie : Micro-organisme unicellulaire. Sa cellule ne comporte pas de noyau. La bactérie est le plus petit organisme autonome, ni animal, ni végétal. Certaines bactéries sont des microbes qui provoquent des maladies (rhume, …) mais d’autres sont très utiles à l’homme (fabrication d’aliments, …)
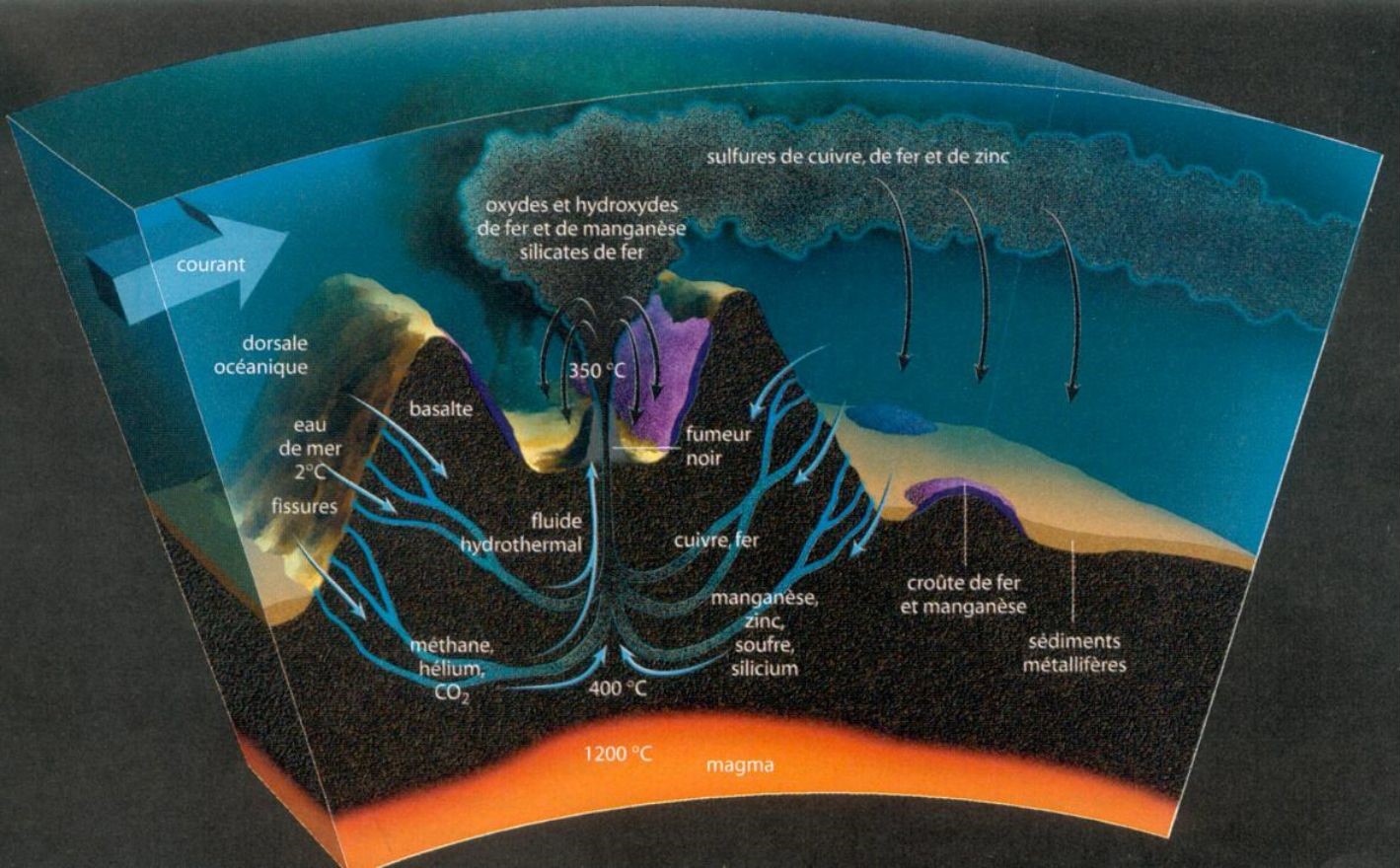
Basalte : Roche magmatique qui constitue, avec les andésites à pyroxène, 95% des laves continentales et océaniques.
Biocatalyseur : Macromolécule biologique, cellule, organite cellulaire ou microorganisme, porteur d’activité catalytique (enzymatique). Un catalyseur est une substance qui, utilisée en faible proportion, augmente la vitesse d’une réaction chimique et qui, théoriquement, reste chimiquement inchangée à la fin de la réaction.
Biologie moléculaire : Discipline scientifique dont l’objet est la compréhension des mécanismes de fonctionnement de la cellule au niveau moléculaire. Le terme « biologie moléculaire » désigne également toutes les techniques de manipulations d’acides nucléiques (ADN, ARN).
Biomasse : Masse de l’ensemble des organismes vivant dans un biotope délimité.
Biopolymère : Ensemble des macromolécules biologiques résultant de l’assemblage de molécules plus simples ou monomères.
Biosorbant : Microorganismes qui, seuls ou en conjonction d’un substrat, peuvent extraire et/ou concentrer une molécule désirée par sa rétention sélective.
Biotransformation : Terme général s’appliquant à toute transformation d’une substance par un biocatalyseur.
Cellulose : Polymère du glucose. La cellulose, constituant essentiel des membranes végétales, ne peut pas être digérée par le tube digestif de l’homme qui est dépourvu d’enzymes spécifiques. Par contre, elle est indispensable pour que le transit intestinal s’effectue normalement car son volume assure l’efficacité des mouvements intestinaux. On dit qu’elle joue le rôle de lest ou de ballast. Elle est utilisée notamment dans la médecine (matériel de pansement), l’industrie papetière (fabrication de la pâte à papier), l’industrie textile (coton, jute, lin, …).
Chimiosynthétiques sulfo-oxydantes : Ces bactéries transforment les sulfures en soufre et le soufre en acide sulfurique.
Convection : Transport de chaleur sous l’effet des mouvements d’un liquide, d’un gaz…
Croûte océanique : Elle représente 60% de la surface terrestre et forme essentiellement le fond des océans. Elle est beaucoup plus fine (5 à 7 km en général) que la croûte continentale et est formée de roches basaltiques et de gabbros.
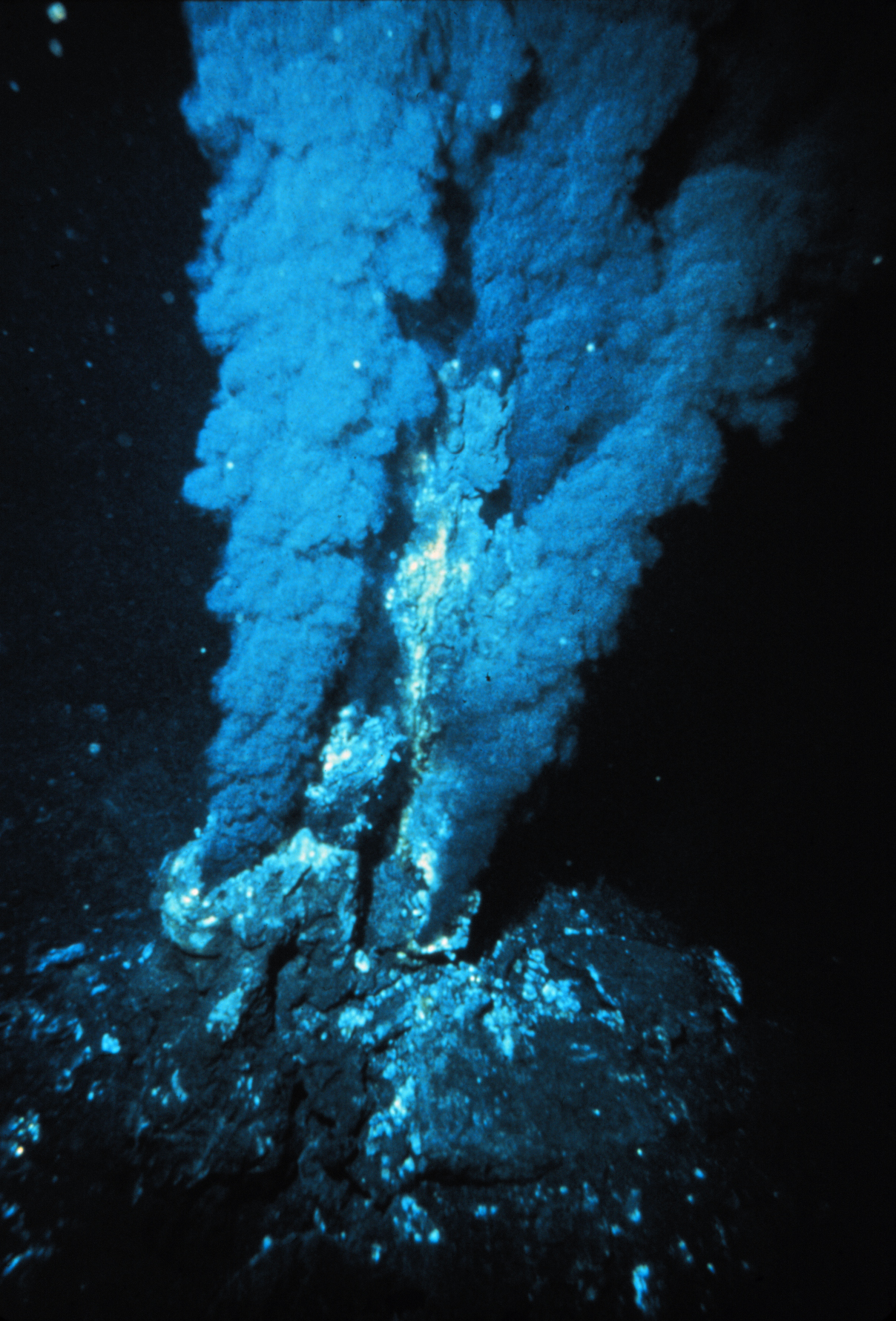
Dorsale océanique : Ligne continue de montagnes sous-marines, lieu où se forme la croûte océanique
Enzyme : Les enzymes sont des protéines macro-moléculaires qui catalysent la quasi-totalité des réactions chimiques dans les organismes vivants. Par exemple, lors de la digestion, ce sont des enzymes qui accélèrent la décomposition et la transformation des aliments.
Les enzymes isolées peuvent être utilisables soit directement dans des secteurs industriels variés (détergents, textile, cuir, médicament, papier, alimentation), soit indirectement, comme catalyseurs dans les processus biochimiques.
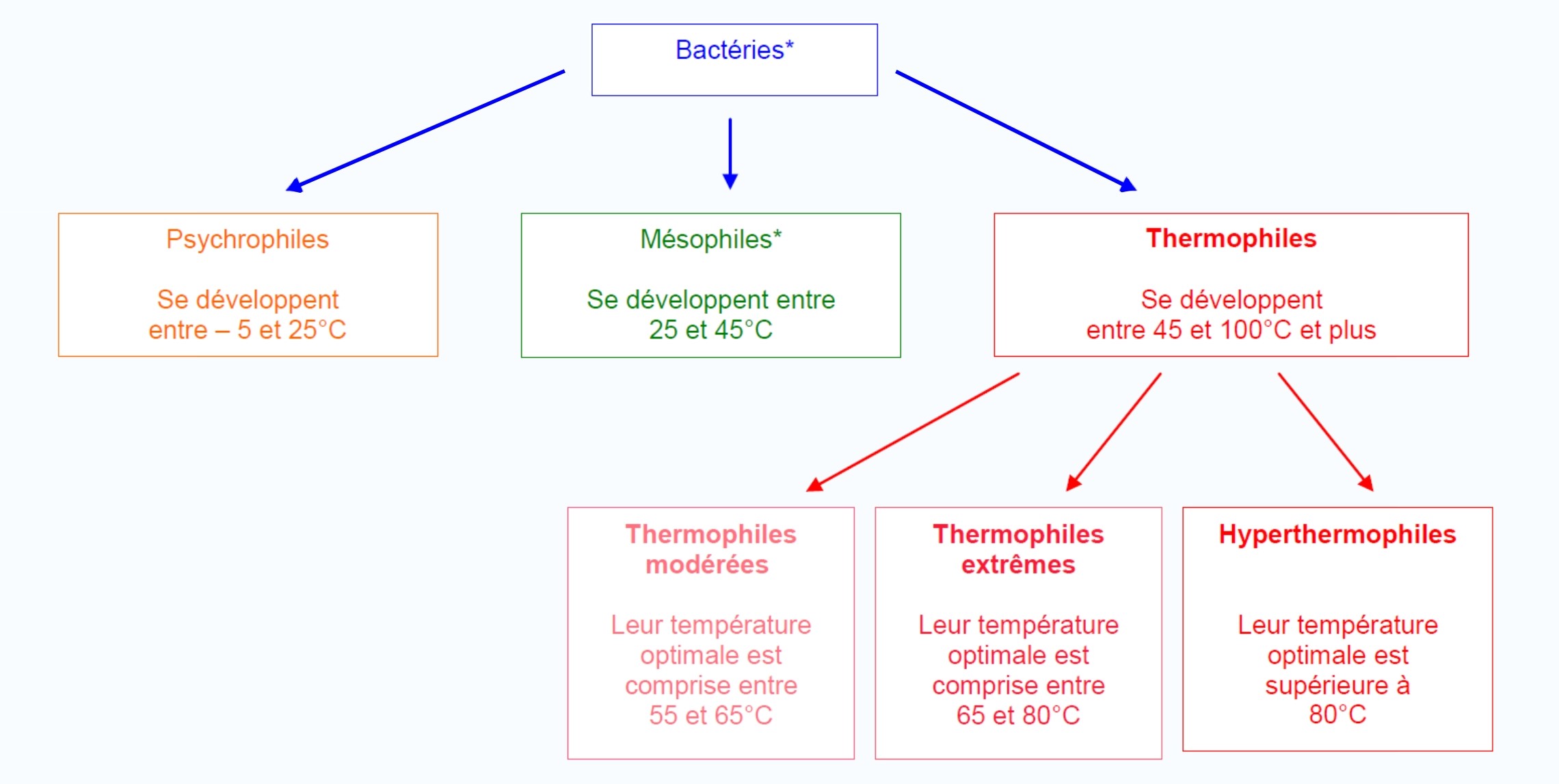
Extrêmophiles : Un nombre plus que surprenant de microorganismes s’épanouit dans des conditions que l’on peut qualifier pour le moins d’extrême. Répartis en différents groupes, ils occupent des niches écologiques souvent caractéristiques : forte pression, forte température, milieu acide…
Extrêmophiles :
- Thermophiles : croissance optimale à des températures élevées
- Cryophiles : croissance optimale à des températures basses
- Alcalophiles : croissance optimale à des pH élevés
- Acidophiles : croissance optimale à des pH bas
- Halophiles : croissance optimale lorsque la salinité est élevée
- Barophiles : croissance optimale aux hautes pressions
Dans un biotope donné, plusieurs paramètres extrêmes peuvent souvent se cumuler. On rencontre par exemple des espèces baro-thermophiles au niveau des sources chaudes dans les grands fonds océaniques où la température et la pression sont élevées.
GDR : Groupe de recherche associant, autour d’un programme, différents laboratoires et structures de recherche.
Gène : Petit segment d’ADN qui indique aux cellules de l’organisme comment fabriquer les protéines. L’ADN des cellules humaines comporte environ 30 000 gènes. Chaque gène est formé de codons et chacun de ces codons est formé de 3 bases azotées, choisies parmi les 4 sortes de bases azotées possibles (l’adénine (A), la thymine (T), la cytosine (C), la guanine (G)).
Génie génétique : Ensemble de techniques qui permettent la manipulation des gènes. Les applications les plus récentes du génie génétique sont la thérapie génique, pour soigner certaines maladies héréditaires, et la création de nouveaux organismes, appelés « organismes transgéniques » ou « organismes génétiquement modifiés » (OGM), qui présentent des caractéristiques intéressantes pour l’agriculture, l’élevage et la santé.
Génome : Ensemble des gènes portés par les chromosomes.
Géothermique : Relatif à la chaleur de la Terre. (Synonyme : géothermal)
Hétérotrophe : Organisme vivant incapable de produire sa propre matière organique à partir de matière minérale. Les hétérotrophes se procurent donc leur matière organique en la prélevant soit sur d’autres organismes vivants (cas des prédateurs, des parasites) ou morts (nécrophages) soit sur les restes d’autres êtres vivants (feuilles mortes, excréments…).
Hydrolyser : Soumettre (une substance) à une réaction chimique de double décomposition par l’action de l’eau.
Au cours de l’hydrolyse d’une substance, les molécules d’eau se dissocient pour former de nouvelles molécules avec les éléments de la substance hydrolysée. L’hydrolyse est utilisée dans de nombreux secteurs industriels. Dans l’industrie alimentaire, par exemple, certaines protéines sont hydrolysées pour en diminuer le potentiel allergène ou en favoriser l’absorption dans l’organisme.
Lipase : Enzyme qui active l’hydrolyse des lipides, libérant des acides gras.
Lipides : Nom générique des esters d’acides gras rencontrés dans les tissus vivants, de poids moléculaires élevés, et qui sont caractérisés par leur insolubilité dans l’eau et leur solubilité dans les solvants organiques (chloroforme, éther, alcool, etc.).
Mésophile : Se dit d’un microorganisme qui peut vivre à des températures variant de 20 à 45 °C et dont le développement est optimal à 37 °C.
Oncologie : Partie de la médecine qui s’intéresse à l’étude des tumeurs. Le terme oncologie est de plus en plus souvent utilisé pour désigner l’étude des cancers malgré l’existence du terme cancérologie.
Pascal : Unité de mesure de contrainte et de pression du système international (symbole Pa). 1 mégapascal (Mpa) est égal à 106 Pa.
Plaque lithosphérique : Couche superficielle de la planète formée de la croûte et du manteau supérieur et découpée en plaques mobiles, les plaques lithosphériques.
Pluricellulaire : Se dit d’un organisme composé d’un nombre de cellules plus ou moins élevées.
Polymère : Substance constituée de molécules caractérisées par la répétition d’un ou plusieurs types de motifs monomères.
On distingue les polymères naturels (caoutchouc, cellulose – bois, papier, fibres végétales-, collagène) et les polymères industriels : polyamide, polyéthylène, polypropylène… Les polymères sont utilisés dans la fabrication d’un nombre très important d’objets (exemples : couches pour bébés, CD, vêtements, moquette, jouets…).
Polysaccharide : Composé constitué par la polycondensation d’une grande quantité de molécules d’oses (amidon, cellulose etc.). Synonyme : polyoside ou polyholoside.
Protéase : Enzyme agissant sur les protides pour les décomposer en leurs différents constituants, principalement les acides aminés.
Protéines : Elles sont constituées de chaînes d’acides aminés. Elles permettent de construire les tissus, et dans le cas des enzymes, de contrôler des réactions chimiques. L’immunoglobuline est une protéine particulièrement importante qui protège l’organisme contre les bactéries et les virus.
Substrat : Molécule sur laquelle agit une enzyme.
Symbiose : Association de deux êtres vivants d’espèces différentes, qui est profitable à chacun d’eux.
Thermostablité : Etat d’une substance qui n’est pas altéré par une élévation de température.
Thixotropie : Propriété qu’ont certains fluides de passer d’un état visqueux à un état liquide lorsqu’on les agite et de retrouver leur état initial après un temps de repos.
Unicellulaire : Se dit d’un organisme composé d’une cellule unique.
Xylane : Polysaccharide. C’est un des constituants principaux des hémicelluloses obtenues à partir des bois.